Нобелевские премии по физиологии, медицине и химии – 2019: на шаг ближе к победе над раком

20.09.2019
11730
Ниязбек Бектембаев
Нобелевскую премию в области физиологии и медицины в этом году дали за открытие того, как клетки чувствуют и адаптируются к доступности кислорода, а по химии – за разработку литий-ионных аккумуляторов. Рассмотрим их поподробнее.
Премию по физиологии и медицине 7 октября текущего года присудили трём ученым – Уильяму Г. Келин-младшему, Греггу Л. Семенцу и Сэру Петер Дж. Ратклиффу[1] за их открытие того, как клетки чувствуют и адаптируются к доступности кислорода.
Как уже известно, ключевым физиологическим ответом на гипоксию (мало кислорода) является повышение уровня гормона эритропоэтина (EPO – erythropoietin) в печени, что приводит к увеличению продукции эритроцитов (эритропоэз). Грегг Семенца изучил ген EPO и то, как он регулируется изменением уровня кислорода. Используя генно-модифицированных мышей, специфические сегменты ДНК, расположенные рядом с геном EPO, опосредуют ответ на гипоксию. Сэр Петер Ратклифф также изучил этот вопрос, и обе исследовательские группы обнаружили, что механизм восприятия кислорода присутствует практически во всех тканях, а не только в клетках почек.
В то же время Семенца в культивируемых клетках печени обнаружил белковый комплекс, который связывается с идентифицированным сегментом ДНК кислородно-зависимым образом. Он назвал этот комплекс индуцируемым гипоксией фактором (HIF –hypoxia-inducible factor), и в 1995 г. Семенца также обнаружил, что HIF состоит из двух различных ДНК-связывающих белков, так называемых факторов транскрипции, которые теперь называются индуцируемый гипоксией фактор 1-альфа (HIF-1α – hypoxia-inducible factor-1 alpha) и ядерный транслокатор (переносчик) рецептора ароматических углеводородов (ARNT – aryl hydrocarbon receptor nuclear translocator).
Когда уровень кислорода низок (гипоксия), количество HIF-1α увеличивается, так что он может связываться с геном EPO, следовательно, регулировать его с другими генами, связанными с HIF-связывающими сегментами ДНК (рис. 1). Несколько исследовательских групп показали, что HIF-1α, который обычно быстро разлагается, защищен от разложения при гипоксии. При нормальном уровне кислорода клеточный аппарат, называемый протеасомой, разлагает HIF-1α. В таких условиях небольшой пептид, убиквитин, добавляется к белку HIF-1α. Убиквитин функционирует как метка для белков, предназначенных для деградации в протеасоме.
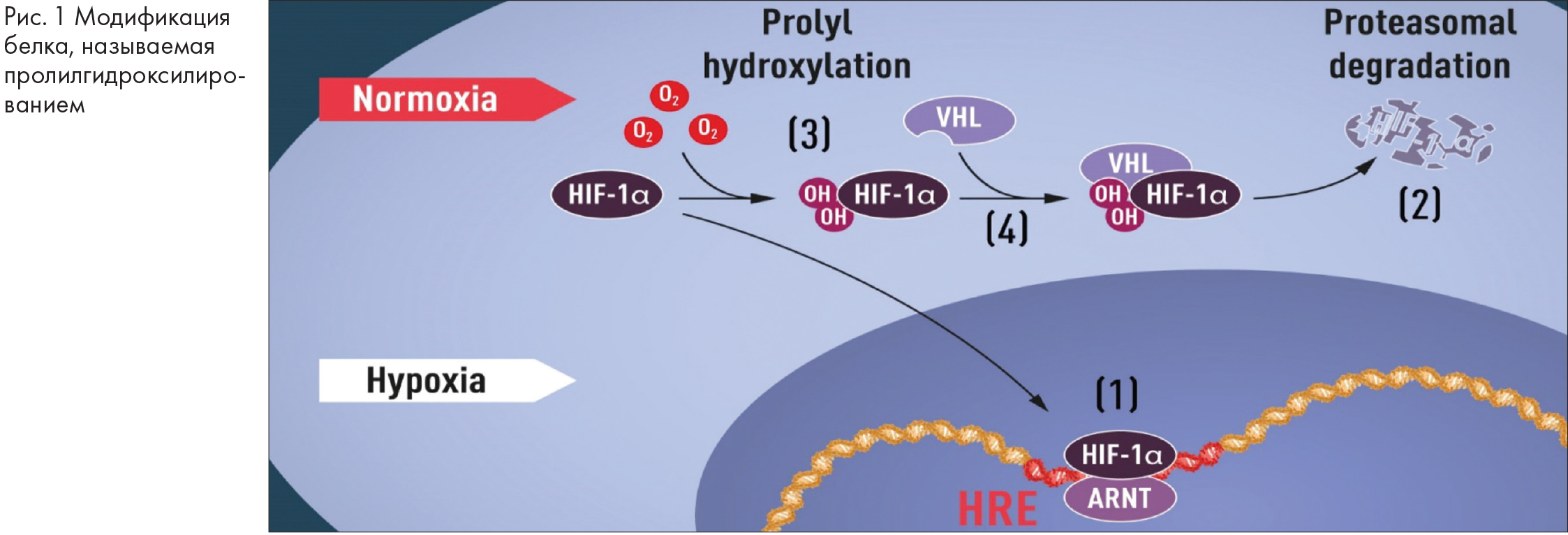
Примерно в то же время, когда Семенца и Ратклифф изучали регуляцию гена EPO, исследователь рака Уильям Келин-младший постигал наследственный синдром – болезнь фон Гиппеля-Линдау (болезнь VHL – von Hippel-Lindau). Это генетическое заболевание приводит к значительному увеличению риска некоторых видов рака в семьях с наследственными мутациями VHL. Келин показал, что ген VHL кодирует белок, который предотвращает возникновение рака. Келин также показал, что раковые клетки, лишенные функционального гена VHL, экспрессируют аномально высокие уровни генов, регулируемых гипоксией. Но когда ген VHL был вновь введен в раковые клетки, нормальные уровни восстановились. Это стало важным ключом, подтверждающим, что VHL каким-то образом участвует в контроле реакций на гипоксию. Дополнительные сведения поступили от нескольких исследовательских групп, показавших, что VHL является частью комплекса, который маркирует белки убиквитином, маркируя их для деградации в протеасоме. Затем Ратклифф и его исследовательская группа сделали ключевое открытие: продемонстрировали, что VHL может физически взаимодействовать с HIF-1α и необходим для его разложения при нормальных уровнях кислорода. Это окончательно связало VHL с HIF-1α.
Кислород сдвигает баланс
Многие части встали на свои места, но по-прежнему не хватало понимания того, как уровни O2 регулируют взаимодействие между VHL и HIF-1α. Поиск был сосредоточен на определенной части белка HIF-1α, о которой известно, что она важна для VHL-зависимой деградации, и как Келин, так и Ратклифф подозревали, что ключ к чувствительности к O2 находится где-то в этом домене белка. В 2001 году в двух одновременно опубликованных статьях было показано, что при нормальных уровнях кислорода гидроксильные группы добавляются в двух конкретных положениях в HIF-1α (рис. 1). Эта модификация белка, называемая пролилгидроксилированием, позволяет VHL распознавать и связываться с HIF-1α и, таким образом, объясняет, как нормальные уровни кислорода контролируют быструю деградацию HIF-1α с помощью чувствительных к кислороду ферментов. Дальнейшие исследования Ратклиффа и других выявили ответственные пролилгидроксилазы. Также было доказано, что функция активации гена HIF-1α регулируется кислородзависимым гидроксилированием. Таким образом, нобелевские лауреаты выяснили механизм определения кислорода и показали, как он работает.
Благодаря новаторской работе этих нобелевских лауреатов, мы знаем гораздо больше о том, как различные уровни кислорода регулируют фундаментальные физиологические процессы. Кислородное зондирование позволяет клеткам адаптировать свой метаболизм к низким уровням кислорода: например, в наших мышцах во время интенсивных упражнений. Другие примеры адаптивных процессов, контролируемых кислородным зондированием, включают образование новых кровеносных сосудов и выработку эритроцитов. Наша иммунная система и многие другие физиологические функции также настраиваются с помощью O2 чувствительного механизма. Кислородное зондирование даже было показано в процессе развития плода для контроля нормального образования кровеносных сосудов и развития плаценты.
Кислородное зондирование занимает центральное место в большом количестве заболеваний. Например, пациенты с хронической почечной недостаточностью часто страдают от тяжелой анемии из-за снижения экспрессии EPO. EPO вырабатывается клетками почки и необходим для контроля образования красных кровяных клеток, как объяснено выше. Кроме того, кислородный механизм играет важную роль в раке. В опухолях механизм, регулируемый кислородом, используется для стимуляции образования кровеносных сосудов и изменения метаболизма для эффективной пролиферации раковых клеток. Интенсивные усилия, предпринимаемые в академических лабораториях и фармацевтических компаниях, теперь направлены на разработку лекарств, которые могут воздействовать на различные болезненные состояния, активируя или блокируя чувствительный к кислороду механизм.
Перезаряжаемый мир
Нобелевская премия по химии в 2019 г. присуждена трем ученым – Джону Б. Гуденафу, М. Стенли Уиттингхему и Акиру Йошино за разработку литий-ионных аккумуляторов.
Основа литий-ионной батареи была заложена во время нефтяного кризиса 1970-х годов. Стэнли Уиттингем работал над разработкой методов, которые могли бы привести к использованию технологий, не затрагивающих ископаемое топливо. Он начал исследовать сверхпроводники и обнаружил чрезвычайно энергоемкий материал, который он использовал для создания инновационного катода в литиевой батарее. Однако батарея оказалась слишком взрывоопасной, чтобы стать жизнеспособной.
Джон Гуденаф предсказал, что катод получит еще больший потенциал, если будет сделан с использованием оксида металла вместо сульфида металла. После систематического поиска в 1980 году ученый продемонстрировал, что оксид кобальта с интеркалированными ионами лития может производить до четырех вольт. Это был важный прорыв, который привел к появлению гораздо более мощных батарей. На основе работы Гуденафа в 1985 году Акира Йошино создал первую коммерчески жизнеспособную литий-ионную батарею. В результате получился легкий, износостойкий аккумулятор, который можно заряжать сотни раз, прежде чем его характеристики ухудшатся. Впервые эти батарейки появились на рынке в 1991 году. Они заложили основу беспроводного общества, свободного от ископаемого топлива, и приносят наибольшую пользу человечеству.
[1] The Nobel Prize in Physiology or Medicine 2019. NobelPrize.org. Nobel Media AB 2019. Tue. 15.10.2019 г. https://www.nobelprize.org/prizes/medicine/2019/press-release/
Нобелевскую премию в области физиологии и медицины в этом году дали за открытие того, как клетки чувствуют и адаптируются к доступности кислорода, а по химии – за разработку литий-ионных аккумуляторов. Рассмотрим их поподробнее.
Премию по физиологии и медицине 7 октября текущего года присудили трём ученым – Уильяму Г. Келин-младшему, Греггу Л. Семенцу и Сэру Петер Дж. Ратклиффу[1] за их открытие того, как клетки чувствуют и адаптируются к доступности кислорода.
Как уже известно, ключевым физиологическим ответом на гипоксию (мало кислорода) является повышение уровня гормона эритропоэтина (EPO – erythropoietin) в печени, что приводит к увеличению продукции эритроцитов (эритропоэз). Грегг Семенца изучил ген EPO и то, как он регулируется изменением уровня кислорода. Используя генно-модифицированных мышей, специфические сегменты ДНК, расположенные рядом с геном EPO, опосредуют ответ на гипоксию. Сэр Петер Ратклифф также изучил этот вопрос, и обе исследовательские группы обнаружили, что механизм восприятия кислорода присутствует практически во всех тканях, а не только в клетках почек.
В то же время Семенца в культивируемых клетках печени обнаружил белковый комплекс, который связывается с идентифицированным сегментом ДНК кислородно-зависимым образом. Он назвал этот комплекс индуцируемым гипоксией фактором (HIF –hypoxia-inducible factor), и в 1995 г. Семенца также обнаружил, что HIF состоит из двух различных ДНК-связывающих белков, так называемых факторов транскрипции, которые теперь называются индуцируемый гипоксией фактор 1-альфа (HIF-1α – hypoxia-inducible factor-1 alpha) и ядерный транслокатор (переносчик) рецептора ароматических углеводородов (ARNT – aryl hydrocarbon receptor nuclear translocator).
Когда уровень кислорода низок (гипоксия), количество HIF-1α увеличивается, так что он может связываться с геном EPO, следовательно, регулировать его с другими генами, связанными с HIF-связывающими сегментами ДНК (рис. 1). Несколько исследовательских групп показали, что HIF-1α, который обычно быстро разлагается, защищен от разложения при гипоксии. При нормальном уровне кислорода клеточный аппарат, называемый протеасомой, разлагает HIF-1α. В таких условиях небольшой пептид, убиквитин, добавляется к белку HIF-1α. Убиквитин функционирует как метка для белков, предназначенных для деградации в протеасоме.

Примерно в то же время, когда Семенца и Ратклифф изучали регуляцию гена EPO, исследователь рака Уильям Келин-младший постигал наследственный синдром – болезнь фон Гиппеля-Линдау (болезнь VHL – von Hippel-Lindau). Это генетическое заболевание приводит к значительному увеличению риска некоторых видов рака в семьях с наследственными мутациями VHL. Келин показал, что ген VHL кодирует белок, который предотвращает возникновение рака. Келин также показал, что раковые клетки, лишенные функционального гена VHL, экспрессируют аномально высокие уровни генов, регулируемых гипоксией. Но когда ген VHL был вновь введен в раковые клетки, нормальные уровни восстановились. Это стало важным ключом, подтверждающим, что VHL каким-то образом участвует в контроле реакций на гипоксию. Дополнительные сведения поступили от нескольких исследовательских групп, показавших, что VHL является частью комплекса, который маркирует белки убиквитином, маркируя их для деградации в протеасоме. Затем Ратклифф и его исследовательская группа сделали ключевое открытие: продемонстрировали, что VHL может физически взаимодействовать с HIF-1α и необходим для его разложения при нормальных уровнях кислорода. Это окончательно связало VHL с HIF-1α.
Кислород сдвигает баланс
Многие части встали на свои места, но по-прежнему не хватало понимания того, как уровни O2 регулируют взаимодействие между VHL и HIF-1α. Поиск был сосредоточен на определенной части белка HIF-1α, о которой известно, что она важна для VHL-зависимой деградации, и как Келин, так и Ратклифф подозревали, что ключ к чувствительности к O2 находится где-то в этом домене белка. В 2001 году в двух одновременно опубликованных статьях было показано, что при нормальных уровнях кислорода гидроксильные группы добавляются в двух конкретных положениях в HIF-1α (рис. 1). Эта модификация белка, называемая пролилгидроксилированием, позволяет VHL распознавать и связываться с HIF-1α и, таким образом, объясняет, как нормальные уровни кислорода контролируют быструю деградацию HIF-1α с помощью чувствительных к кислороду ферментов. Дальнейшие исследования Ратклиффа и других выявили ответственные пролилгидроксилазы. Также было доказано, что функция активации гена HIF-1α регулируется кислородзависимым гидроксилированием. Таким образом, нобелевские лауреаты выяснили механизм определения кислорода и показали, как он работает.
Благодаря новаторской работе этих нобелевских лауреатов, мы знаем гораздо больше о том, как различные уровни кислорода регулируют фундаментальные физиологические процессы. Кислородное зондирование позволяет клеткам адаптировать свой метаболизм к низким уровням кислорода: например, в наших мышцах во время интенсивных упражнений. Другие примеры адаптивных процессов, контролируемых кислородным зондированием, включают образование новых кровеносных сосудов и выработку эритроцитов. Наша иммунная система и многие другие физиологические функции также настраиваются с помощью O2 чувствительного механизма. Кислородное зондирование даже было показано в процессе развития плода для контроля нормального образования кровеносных сосудов и развития плаценты.
Кислородное зондирование занимает центральное место в большом количестве заболеваний. Например, пациенты с хронической почечной недостаточностью часто страдают от тяжелой анемии из-за снижения экспрессии EPO. EPO вырабатывается клетками почки и необходим для контроля образования красных кровяных клеток, как объяснено выше. Кроме того, кислородный механизм играет важную роль в раке. В опухолях механизм, регулируемый кислородом, используется для стимуляции образования кровеносных сосудов и изменения метаболизма для эффективной пролиферации раковых клеток. Интенсивные усилия, предпринимаемые в академических лабораториях и фармацевтических компаниях, теперь направлены на разработку лекарств, которые могут воздействовать на различные болезненные состояния, активируя или блокируя чувствительный к кислороду механизм.
Перезаряжаемый мир
Нобелевская премия по химии в 2019 г. присуждена трем ученым – Джону Б. Гуденафу, М. Стенли Уиттингхему и Акиру Йошино за разработку литий-ионных аккумуляторов.
Основа литий-ионной батареи была заложена во время нефтяного кризиса 1970-х годов. Стэнли Уиттингем работал над разработкой методов, которые могли бы привести к использованию технологий, не затрагивающих ископаемое топливо. Он начал исследовать сверхпроводники и обнаружил чрезвычайно энергоемкий материал, который он использовал для создания инновационного катода в литиевой батарее. Однако батарея оказалась слишком взрывоопасной, чтобы стать жизнеспособной.
Джон Гуденаф предсказал, что катод получит еще больший потенциал, если будет сделан с использованием оксида металла вместо сульфида металла. После систематического поиска в 1980 году ученый продемонстрировал, что оксид кобальта с интеркалированными ионами лития может производить до четырех вольт. Это был важный прорыв, который привел к появлению гораздо более мощных батарей. На основе работы Гуденафа в 1985 году Акира Йошино создал первую коммерчески жизнеспособную литий-ионную батарею. В результате получился легкий, износостойкий аккумулятор, который можно заряжать сотни раз, прежде чем его характеристики ухудшатся. Впервые эти батарейки появились на рынке в 1991 году. Они заложили основу беспроводного общества, свободного от ископаемого топлива, и приносят наибольшую пользу человечеству.
[1] The Nobel Prize in Physiology or Medicine 2019. NobelPrize.org. Nobel Media AB 2019. Tue. 15.10.2019 г. https://www.nobelprize.org/prizes/medicine/2019/press-release/
Похожие статьи
1. Экономика Казахстана: Замедляемся2. Оптимизация правительства
3. Нобелевская премия по медицине 2014: «внутренняя GPS»
4. Самая дорогая болезнь для мировой экономики
5. Демографические сдвиги и недвижимость: время отлива


